|
ФИЗИКО-ХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ЗОЛОТОНОСНЫХ СУЛЬФОАРСЕНИДНЫХ РАСТВОРОВ В ГРАНИТНЫХ СИСТЕМАХ
*Институт геохимии СО РАН, Иркутск, Россия, vilor@igc.irk.ru **Научно-исследовательский геотехнологический центр ДВО РАН, Петропавловск-Камчатский, Россия, kazmin@igc.irk.ru
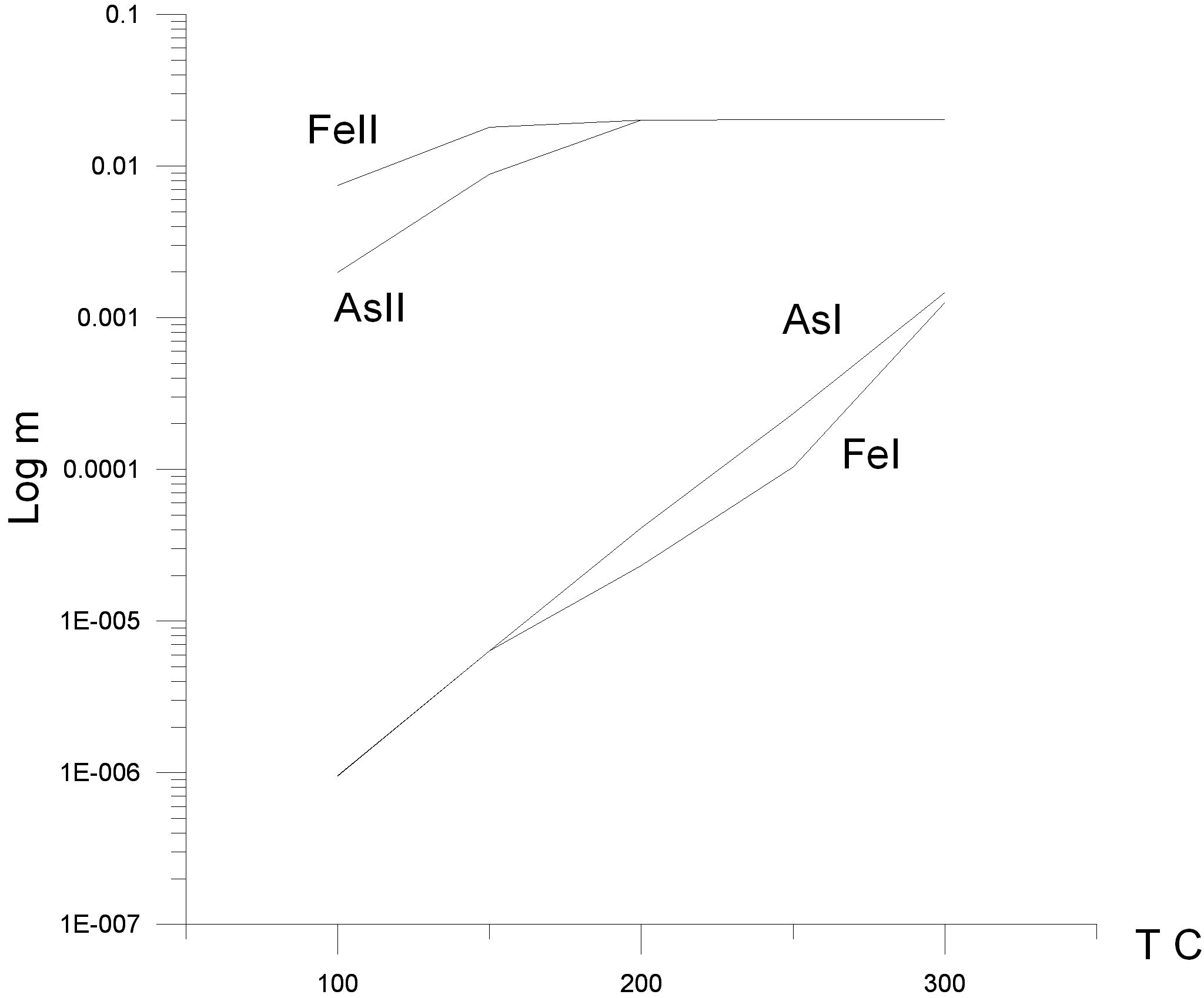
Все крупнейшие золоторудные месторождения, как объективно показано в обширнейшей библиографии за последние несколько десятилетий, связаны непосредственно и парагенетически с гранитообразованием как при островодужной, так и в коллизионной геодинамических обстановках. Золотое оруденение формируется в тесной ассоциации с разнообразными по составу сульфидными и сульфоарсенидными системами. Последние содержат рудную группу Au – Ag – As, являющуюся прямым поисковым признаком продуктивности объектов. Сульфоарсенидные системы возникают в удаленных надинтрузивных областях гранитных плутонов, перераспределяя золото, заключенное в ранних минеральных ассоциациях, и локально концентрируя его в арсенопиритовом типе руд. С целью определения важной геохимической роли мышьяка при формировании высокопродуктивного золотого оруденения, связанного с гранитными ареалами, привлечено физико-химическое моделирование на основе программного комплекса «Селектор». Данный расчетный метод имеет свои затруднения при непосредственном решении поставленной задачи, заключающиеся в недостатке информации химической – о составе комплексов и соединений и термодинамической - частичного или полного отсутствия термодинамических констант для них. Дефицит информации в базе исходных термодинамических данных существует не только для золотомышьяковых комплексов, но и для соединений мышьяка, железа и серы, необходимых при изучении совместного переноса Au, As, S и Fe в присутствии рудных сульфидов и оксидов – компонентов важнейших буферных парагенезисов: пирита, пирротина, арсенопирита и магнетита. Поэтому в применяемой последовательности расчетов сложная рудообразующая гидротермальная система Au – Fe - As – Na – S – Cl – H – O разделена на 3 подсистемы: 1) As – Na – S – Cl – H – O, 2) Fe - As – Na – S – Cl – H –O и 3) Au - As – Na – S – Cl – H – O. С применением метода решения обратной термодинамической задачи разработана непротиворечивая согласованная база термодинамических данных для первой системы (Вилор, Казьмин, 2007). Установлен основной геохимический тренд миграции As в глубинных гидротермах, обусловленный устойчивостью мышьяк содержащих сульфидных минеральных фаз при низком окислительном потенциале за счет преимущественного образования сульфоарсенитов, более устойчивых, чем с арсениты и арсенаты. Разработка базы термодинамических данных (функций gt) для второй системы Fe - As – Na – S – Cl – H –O включает процедуры их согласования в 3-х подсистемах в интервале рН от 1 до 14: а) для хлоридных растворов в присутствии магнетита (Мг), б) хлоридно-сульфидных растворов в присутствии твердых сульфидов (прежде всего пирита – Пи) и оксидов Fe и в) хлоридно-сульфидно - мышьяковых растворов в термодинамическом равновесии с полной ассоциацией оксидов, сульфидов и арсенидов (арсенопирит – АПи, лелингит – Ле) железа + сульфиды As. Методом решения обратной задачи физико-химического моделирования при анализе экспериментальной работы Tremain et a.l, 1977 сформирована согласованная база термодинамических данных в отношении акваионов Fe, гидрооксо- и хлоридных нейтральных частиц и ионов. Экспериментальной основой для системы «пирит + раствор», в которой численное моделирование и согласование величин функций gt проведено для температур от 100 до 300оС в растворах HCl и хлорида натрия, являлась работа Масаловича, Овчинникова, 1981. При возрастании растворимости Пи с увеличением концентрации HCl и температуры наличие серы усложняет состав зависимых компонентов системы. Список частиц, ответственных за перенос Fe, расширяется в результате образования серии диссоциирующих гидросульфидов, среди которых доминирует ион FeHS+. При моделировании 3-й подсистемы определялась вероятность участия мышьяка в форме тиоарсенитов и тиосернистых полимеров – олигомеров в образовании комплексных частиц с железом в растворе, т.е. возникновения ряда ферротиоарсенитов, ответственных за совместный перенос Fe и As. В тестовых испытаниях соответственно с алгоритмом решения обратной задачи физико-химического моделирования (Вилор, Казьмин, 2007) применялись результаты экспериментальных исследований растворения арсенопирита, полученные Колониным с соавторами(1988) и Покровским с соавторами (2002). В состав системы включены (моль/кг): арсенопирит 1, вода -1 кг, H2S – 0.66 ÷ 0.92 х 10-3, НС1 и NaОН 1 х10-6 ÷ 0.001. Количество водных частиц - 515, газов – 105, твердых фаз – 47. Расчет проведен при 200, 250 и 300о С и давлении от упругости насыщенных паров воды до 500 бар. На 25 и 100оС сделана экстраполяция, соответствующая термодинамическим константам ферротиоарсенитов, установленным в тестовых испытаниях. Рассчитанная зависимость концентраций мышьяка и железа в воде и сероводородном растворе, взаимодействующих с арсенопиритом, от температуры связана с типом его растворения – конгруэнтного или инконгруэнтного (рис.1).
Рис.
1. Рассчитанная растворимость
арсенопирита. 1- давление насыщенных паров воды, 2 – 300
бар.
Под давлением насыщенных паров воды в В исследованном интервале кислотности от 3.53 до 6.34 и содержании H2S от 0.66 х 10-3 до 0.92 х 10 –3моль As находится в растворе в форме тимышьяковой кислоты Н3AsS30 до 2 х10-2 моль с добавлением комплексов As(OH)2HS0 и As(OH)HS+. При давлении насыщенных паров воды около 300оС преобладает мышьяковистая кислота Н3AsО3 . Железо переносится в форме группы гидросульфидов FeHS+, Fe(HS)20, Fe(HS)3- (1.9х10-2 ÷ 5.4х10-4 моль). Им сопутствует акваион Fe 2+, доминирующий до 100 оС при давлении насыщенных паров воды. Роль предполагаемых ферротиоарсенитов Fe(0-3)H(0-3)AsS(1-5) (-1 ÷ +4) в воспроизводимых условия гидротермального процесса незначительна. Таким образом, физико-химическое моделирование представляет процесс растворения арсенопирита как функцию температуры, главным образом, при давлениях около репера насыщенных паров воды, низких щелочности и потенциале серы. Повышение давления придает ведущее значение иным факторам устойчивости этого минерала. Железо и мышьяк транспортируются в раздельных формах.
|